近日,国家医疗保障局官方网站发布了《国家医疗保障局对十四届全国人大二次会议第2090号建议的答复》(以下简称《答复》),就郭汶霞代表提出的《关于继续加大完善医保集采对医疗器械及耗材在执行招采规划上的科学合理性的建议》进行了答复。
在《答复》中,国家医保局除了对医用耗材集采规则及集采的下一步工作考虑作了说明外,《答复》中还特别针对“创新医疗器械的审批情况和创新医疗器械在临床的应用情况”作了说明,并就“创新医疗器械的下一步工作考虑”作了介绍。
《答复》中以北京博辉瑞进开发的三类植入医疗器械“吻合口加固修补片”为例,对创新医疗器械的审批情况作了说明:
“为鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动医疗器械产业高质量发展,原国家食品药品监督管理总局于2014年发布《创新医疗器械特别审批程序(试行)》,将具有我国发明专利,在技术上属于国内首创、国际领先,具有显著临床应用价值的医疗器械纳入特别审批通道,对通道内的产品采取早期介入、专人负责、全程指导的方式,在标准不降低、程序不减少的情况下予以优先审评审批。2018年11月,国家药监局对有关程序进行了修订,进一步完善形成《创新医疗器械特别审查程序》,以便更好地适应医疗器械创新发展需要。
2018年1月,国家药监局公布了包含“吻合口加固修补片”的《创新医疗器械特别审批申请审查结果公示》,“吻合口加固修补片”于2022年8月2日获批注册,其《医疗器械产品注册技术审评报告》已在医疗器械技术审评中心网站公开。

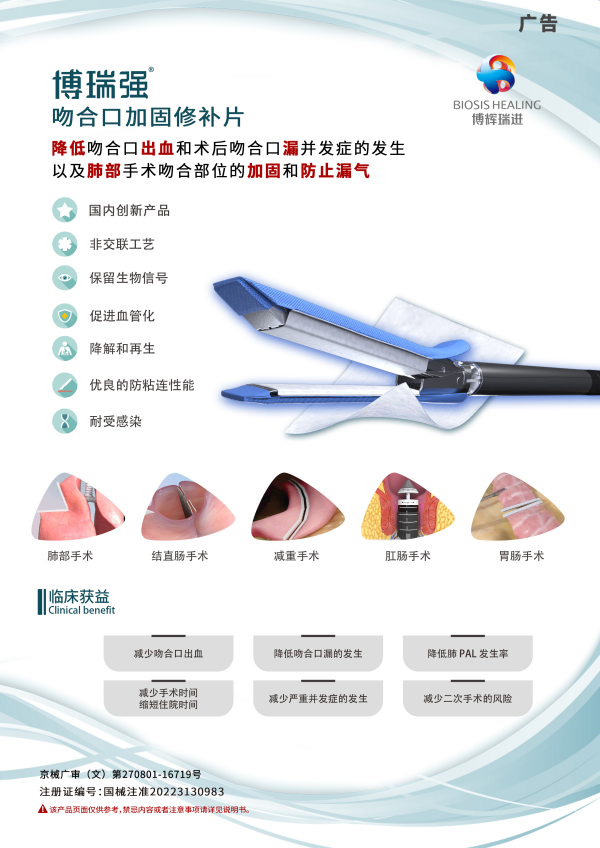
吻合口加固修补片,由博辉瑞进具有完全自主知识产权的非交联细胞外基质源生物材料(SIS材料)制备而成,该产品可配合吻合器用于吻合部位的加固,适用于远端胃切除术、近端胃切除术、袖状胃切除术、胃肠吻合术、结直肠肛门手术,以及肺部手术吻合部位的加固和防止漏气。能够降低吻合口漏、出血等并发症的发生,为患者带来获益。
吻合口加固修补片是国内独家、首款全系列吻合口加固修补产品,同时也是全球首款用于管型吻合器的SIS材料吻合口加固修补产品。符合《创新医疗器械特别审批程序(试行)》中关于“具有我国发明专利”、“技术上属于国内首创、国际领先”、“具有显著临床应用价值”的创新医疗器械产品。
《答复》中对创新医疗器械的下一步工作考虑作了说明:
“针对国产医疗器械创新产品应用方面,国家卫生健康委专项布局了系列医疗器械产品应用解决方案研究、应用评价与示范研究项目,建立产业端和应用端的有效链接。
一是基于已获得注册证的国产创新器械,在临床机构开展新临床技术、新服务模式的解决方案研究,形成可复制的解决方案,为国产创新器械的应用示范和临床推广奠定技术基础。
二是在全国遴选不同地域、不同级别、不同类型的医疗机构,系统开展国产创新产品的产业示范、临床应用评价与示范研究,以解决国产医疗器械打开市场难、拓展市场难的问题。
三是探索在国家临床医学研究中心等平台建设中设置高端国产医疗器械应用示范等考核。”
创新是推动医疗器械产业高质量发展的必经之路,各个国家都非常注重创新医疗器械的发展。在国内,针对创新医疗器械,监管部门出台了一系列政策加快产品上市速度、帮助产品提高市场渗透率和下沉速度;同时政府在科技立项、融资、信贷等方面给予支持,减轻企业负担,为创新医疗器械企业提供了良好的研发、发展环境。
博辉瑞进作为一家以“创新 研发”立足的生物医疗企业,始终将创新研发作为企业的发展根基。对标国际最高水平,集中力量打好关键核心技术攻坚战,除吻合口加固修补片外,博辉瑞进尚有多款创新医疗器械产品在研或已进入取证流程。
我们相信,在国家推出的一系列创新医疗器械利好政策下,将会有越来越多的创新医疗器械产品逐步取证并推向市场,源源不断地为临床注入新的活力,为医生提供更先进的治疗手段,让更多患者因此获益。

理智弄槽外科韵,巴山蜀水天府情。2024...

6月11日,由中华口腔医学会主办的“口腔...

近日,《中华胸心血管外科杂志》2024年...

2024年5月9日,在VBEF未来医疗生...

新春伊始,万象更新。博辉瑞进迎来新春“开...

12月22日,《陕西省际联盟硬脑(脊)膜...

落叶飘零随风拂,初冬悄然而至。随着冬天一...

清风入梦时,春和正景明。四月芳菲至,等你...

对一个家庭来说,最大的喜事之一,莫过于添...

截止目前,全球已有十余款新冠疫苗在多个国...
版权所有北京博辉瑞进生物科技有限公司 京ICP备16026579号 (京)-非经营性-2017-0030  京公网安备 11011502006176号 (京)网药械信息备字(2022)第00096号
京公网安备 11011502006176号 (京)网药械信息备字(2022)第00096号